KONFIGURASI RELATIF DAN KONFIGURASI MUTLAK
Sebelum
kita membahas mengenai konfigurasi relatif dan konfigurasi mutlak kita akan
membahas mengenai enantiomer dan molekul kiral. Enantiomer
(dalam bahasa Yunani enantio berarti
berlawanan/opposite) adalah molekul
bayangan cermin yang tidak dapat dihimpitkan. Jika suatu molekul tidak dapat
dihimpitkan dengan bayangan cerminnya berarti kedua senyawa enantiomer disebut
kiral/chiral (ky-ral dalam bahasa
Yunani cheir, berarti “tangan”).
Bagaimana
kita memprediksi apakah suatu molekul tersebut kiral atau tidak? Molekul yang
tidak kiral jika mengandung sisi simetri (plane
of chemistry). Sisi simetri yang dimaksud adalah sisi datar yang dipotong
melewati tengah-tengah dari molekul. Sebagai contoh tabung Erlenmeyer mempunyai
sisi simetri. Jika kita memotong tabung Erlenmeyer secara vertikal, akan nampak
sisi satu akan merupakan bayangan cermin sisi yang lain. Salah satu tangan kita
tidak mempunyai sisi simetri karena sisi setengahnya bukan merupakan bayangan
cermin.
Molekul
yang mempunyai sisi simetri dalam berbagai kemungkinan dalam konformasinya
harus identik dengan bayangan cermin dan karena itu merupakan senyawa nonkiral
atau biasa disebut akiral.
Kebanyakan,
walau tidak semua, penyebab adanya kiralitas pada suatu senyawa dikarenakan
adanya atom karbon yang mengikat 4 gugus berbeda. Atom karbon tersebut
diistilahkan sebagai pusat kiralitas (chirality centers). Catatan, kiralitas
merupak sifat dari keseluruhan molekul, dimana pusat kiralitas adalah ciri
struktur yang menyebabkan kiralitas.
Kiralitas
bukan hanya ditentukan berdasarkan perbedaan atom yang terikat langsung pada
karbon, tetapi perbedaan keempat gugus yang terikat pada karbon sebagai pusat
kiral. Misalnya, 5-bromodekana merupakan senyawa kiral karena mengikat empat
gugus yang berbeda.
AKTIVITAS
OPTIKAL
Di samping mengenai kiralitas, struktur-struktur
pasangan enantiomer adalah sama. Oleh karena itu, hampir semua sifat fisika dan
kimianya juga sama. Misalnya, tiap enantiomer murni mempunyai titik lebur dan
titik didih yang sama dengan pasangannya.
Hanya
terdapat dua sifat yang berbeda untuk enantiomer-enantiomer dalam suatu
pasangan enantiomer, yaitu :
1. Antaraksi
dengan senyawa kiral yang lain
2. Antaraksi
dengan cahaya terpolarisasi
Studi mengenai
stereokimia diawali pada abad XIX oleh ilmuwan Prancis, Jean Batiste Biot. Biot
menemukan sifat alami cahaya terpolarisasi bidang (plane-polarized light).
Sebuah
berkas cahaya tersusun atas gelombang elektromagnetik yang berosilasi pada
bidang tak terbatas pada sudut yang tegak lurus terhadap arah rambat gelombang.
Ketika sebuah berkas cahaya melewati polarizer, hanya gelombang terosilasi pada
sebuah bidang yang dapat melewatinya sehingga dinamakan cahaya terpolarisasi
bidang.
Ternyata
beberapa molekul optik aktif dapat memutar bidang polarisasi. Molekul optik
aktif yang memutar bidang polarisasi ke kanan (clockwise) disebut dekstrorotatori (dextrorotatory) atau diberi
notasi (+). Sebaliknya, bila molekul optik aktif memutar bidang polarisasi ke
kiri (counterclockwise) dikatakan
levorotatori atau diberi notasi negatif (-).
Rotasi
spesifik, [α]D, dari suatu senyawa dapat didefinisikan sebagai
rotasi cahaya (λ= 589 nm) yang ditimbulkan ketika sampel berada pada panjang
lintasan 1 dm, di mana konsentrasi sampel 1 gr/mL. Cahaya dengan panjang
gelombang 589 nm disebut dengan garis natrium D.
Pasangan
enantiomer memiliki rotasi spesifik yang nilainya sama, yang berbeda adalah
pada arah perputarannya saja. Misalnya, (+) asam laktat memiliki [α]D
=
+3.82˚ sedangkan (-) asam laktat memiliki [α]D =
+3.82˚. Rotasi spesifik merupakan nilai yang konstan untuk tiap senyawa.
DIAGRAM
PROYEKSI
Menggambarkan struktur
3 dimensi ke 2 dimensi :
- Proyeksi Fischer
- Proyeksi Newman
KONFIGURASI
RELATIF (PROYEKSI FISCHER)
Relatif artinya sesuatu yang
perlu dibandingkan. Jadi, konfigurasi relatif adalah konfigurasi yang membandingkan
penataan atom-atom dalam satu senyawa dengan yang lainnya. Sistem penggambaran
konfigurasi gugus disekitar pusat kiral yang berbeda (susunan ruang
atom atau gugus yang menempel pada karbon kiral), yaitu konvensi D dan L
disebut proyeksi Fischer, yang ditemukan oleh seorang ilmuwan bernama Emil
Fisher.
Proyeksi
Fisher :
·
Vertikal : menjauhi pembaca
·
Horizontal : mendekati pembaca
·
Proyeksi Fisher bisa berotasi dan
dimanipulasi
·
Rotasi 900 tidak
diperbolehkan, karena menghasilkan enantiomer awal
·
Rotasi 1800 menghasilkan
konfigurasi identik, rotasi 2700
menghasilkan
enantiomer
Aturan
penataan ulang proyeksi Fischer :
- Merubah 2 gugus pada proyeksi Fischer :
menghasilkan enantiomer dari senyawa awal.
- Perubahan gugus 2 kali menghasilkan
stereokimia awal
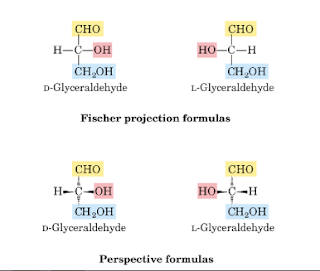
Proyeksi
Fischer terhadap gliseraldehida dengan rantai karbon digambarkan secara
vertikal, dengan karbon yang paling teroksidasi (aldehida) berada pada bagian
paling atas, dengan gambar struktur sebagai berikut :
Gugus
OH pada pusat kiral digambarkan pada sisi sebelah kanan sehingga arah
orientasinya untuk isomer adalah Dekstro (D) dan untuk gugus OH pada sisi
sebelah kiri arah orientassinya untuk isomer adalah Levo (L). Ini berarti
setiap gula yang memiliki stereokimia yang sama dengan D-gliseraldehida
termasuk gula seri D (misalnya D-glukosa), sedangkan gula yang memiliki
stereokimia yang sama dengan L-gliseraldehida termasuk gula seri L. Dimana
penentuan D atau L berdasarkan pada asimetris pada atom karbon molekul yang
kedua dari belakang, yang merupakan C5 pada gambar sebagai berikut :
Seperti yang sudah
dijelaskan diatas molekul dikatakan asimetris jika mengikat 4 gugus atom yang
berbeda. Molekul asimetris itu belum tentu kiral sedangkan kiral sudah pasti
asimetris.
KONFIGURASI
MUTLAK/ABSOLUTE (CAHN-INGOLD-PRELOG)
Mutlak
artinya sudah pasti persis. Jadi, konfigurasi mutlak adalah konfigurasi yang
penataan atom-atomnya dalam ruang 3 dimensi dalam orientasi sudah pasti. Orientasi
disini dimaksudkan apakah searah jarum jam ataukah berlawanan arah jarum jam.
Aturan
Cahn Ingold Prelog
Aturan 1
: Perhatikan 4 atom yang menempel langsung pada pusat kiralitas dan buatlah
prioritas berdasarkan penurunan nomor atom. Atom yang memiliki nomor atom
tertinggi menduduki prioritas pertama, sedangkan atom yang memiliki nomor atom
terendah (biasanya hidrogen) menduduki prioritas keempat.
Aturan 2
: Jika pembuatan prioritas tidak bisa menggunakan aturan 1, bandingkan nomor
atom pada atom kedua masing-masing substituen, dilanjutkan pada atom ketiga dan
seterusnya sampai ditemukan perbedaan nomor atomnya sehingga bisa dibuat
prioritas.
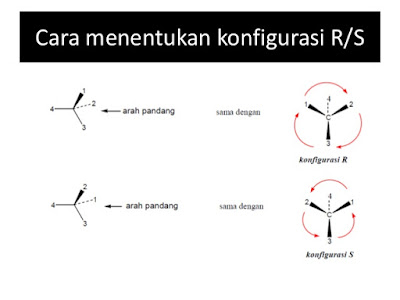
Aturan 3
: Multibonding atom adalah sama dengan nomor atom dengan ikatan tunggal. Setelah dibuat
prioritas pada keempat substituen yang berikatan langsung pada pusat kiral
karbon, kita dapat menentukan konfigurasi stereokimia dengan mengubah orientasi
molekul sehingga substituen prioritas keempat dibuat menjauhi kita. Tiga
substituen yang tersisa akan nampak seperti steer
mobil. Langkah berikutnya membuat arah putaran steer mobil kita berdasarkan urutan dari prioritas pertama sampai
pada akhirnya prioritas ketiga. Jika ternyata arah steer yang kita buat searah
jarum jam (clockwise) maka dikatakan
pusat kiralitas mempunyai konfigurasi
R (huruf R berasal dari Bahasa Latin
rectus yang artinya “kanan”). Jika arah steer kita berlawanan arah dengan
jarum jam (counterclockwise) maka
dikatakan pusat kiralitas mempunyai konfigurasi S (huruf S dari Bahasa
Latin sinister yang artinya “kiri”).