KLASIFIKASI SENYAWA ORGANIK
Hidrokarbon
adalah golongan senyawa karbon yang paling sederhana. Hidrokarbon hanya terdiri
dari unsur atom karbon (C) dan atom hidrogen (H). Walaupun hanya terdiri dari 2
jenis unsur, hidrokarbon merupakan suatu kelompok senyawa yang besar. Seluruh hidrokarbon memiliki rantai karbon dan atom-atom
hidrogen yang berikatan dengan rantai tersebut. Salah satu contoh senyawa
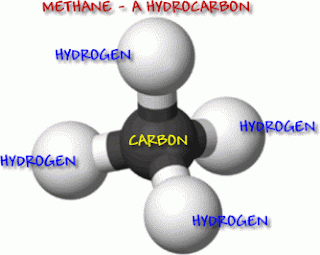
hidrokarbon yang sederhana adalah metana, dengan rumus struktur CH4.
Beberapa contoh hidrokarbon:
Hidrokarbon jenuh hanya mengandung ikatan kovalen tunggal. Dengan demikian,
semua atom karbon dalam molekulnya mempunyai hibridisasi sp3. Hidrokarbon tak jenuh
mengandung ikatan rangkap atau ikatan ganda tiga di antara atom-atom karbonnya.
Atom karbon yang memiliki sebuah ikatan rangkap dengan tetangganya, mempunyai
hibridisasi sp2, sedangkan atom karbon yang memiliki sebuah ikatan
ganda tiga, mempunyai hibridisasi sp.
Hidrokarbon aromatik sebetulnya juga tak jenuh, tetapi kestabilannya jauh
lebih tinggi daripada hidrokarbon tak jenuh, sehingga dimasukkan dalam golongan
yang berbeda, yaitu hidrokarbon aromatik. Senyawa ke-4 (benzena) di atas
termasuk dalam hidrokarbon aromatik.
CIRI-CIRI UMUM
Karena struktur molekulnya berbeda, maka rumus
empiris antara hidrokarbon pun juga berbeda: jumlah hidrokarbon yang diikat
pada alkena dan alkuna pasti lebih sedikit karena atom karbonnya berikatan
rangkap.
Kemampuan hidrokarbon untuk berikatan dengan
dirinya sendiri disebut dengan katenasi, dan menyebabkan hidrokarbon bisa
membentuk senyawa-senyawa yang lebih kompleks, seperti sikloheksana
atau arena seperti benzena. Kemampuan ini didapat karena karakteristik ikatan
diantara atom karbon bersifat non-polar.
Sesuai dengan teori ikatan valensi, atom karbon harus
memenuhi aturan “4-hidrogen” yang menyatakan jumlah atom maksimum yang
dapat berikatan dengan karbon, karena karbon mempunyai 4 elektron valensi.
Dilihat dari elektron valensi ini, maka karbon mempunyai 4 elektron yang bisa
membentuk ikatan kovalen atau ikatan dativ. Hidrokarbon bersifat hidrofobik dan termasuk
dalam lipid.
Beberapa hidrokarbon tersedia melimpah di tata
surya. Danau berisi metana dan etana cair telah ditemukan pada Titan,
satelit alam terbesar Saturnus, seperti dinyatakan oleh Misi Cassini-Huygens.
KLASIFIKASI
HIDROKARBON
1. Senyawa Hidrokarbon Alifatik
Senyawa hidrokarbon alifatik adalah senyawa yang mengandung karbon dan
hidrogen yang bergabung bersama dalam rantai lurus, bercabang atau cincin
non-aromatik. Senyawa ini digunakan sebagai inhibitor korosi.
Hidrokarbon
alkana, alkena dan alkuna adalah senyawa alifatik, seperti asam lemak dan
banyak senyawa lainnya. Kebanyakan senyawa yang mengandung cincin adalah
senyawa aromatik. Dengan demikian, senyawa alifatik adalah kebalikan dari
senyawa aromatik.
Senyawa alifatik dibedakan menjadi :
- Hidrokarbon jenuh/tersaturasi adalah hidrokarbon yang paling sederhana. Hidrokarbon ini seluruhnya terdiri dari ikatan tunggal dan terikat dengan hidrogen. Rumus umum untuk hidrokarbon tersaturasi adalah CnH2n+2.Hidrokarbon jenuh merupakan komposisi utama pada bahan bakar fosil dan ditemukan dalam bentuk rantai lurus maupun bercabang. Hidrokarbon dengan rumus molekul sama tapi rumus strukturnya berbeda dinamakan isomer struktur.
- Hidrokarbon tak jenuh/tak tersaturasi adalah hidrokarbon yang memiliki satu atau lebih ikatan rangkap, baik rangkap dua maupun rangkap tiga. Hidrokarbon yang mempunyai ikatan rangkap dua disebut dengan alkena, dengan rumus umum CnH2n.Hidrokarbon yang mempunyai ikatan rangkap tiga disebut alkuna, dengan rumus umum CnH2n-2.
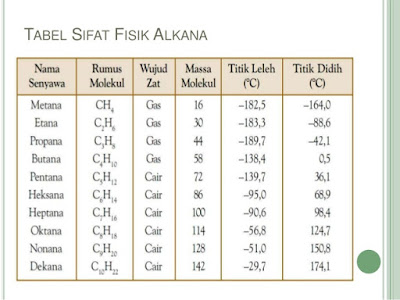
ALKANA
Alkana (juga disebut dengan parafin) adalah senyawa kimia hidrokarbon jenuh
asiklis. Alkana termasuk senyawa alifatik. Dengan kata lain,
alkana adalah sebuah rantai karbon panjang dengan
ikatan-ikatan tunggal. Rumus umum untuk alkana adalah CnH2n+2.
Alkana yang paling sederhana adalah metana dengan rumus CH4. Tidak ada batasan berapa
karbon yang dapat terikat bersama. Beberapa jenis minyak dan wax
adalah contoh alkana dengan atom jumlah atom karbon yang besar, bisa lebih dari
10 atom karbon.
Setiap atom karbon
mempunyai 4 ikatan (baik ikatan C-H
atau ikatan C-C),
dan setiap atom hidrogen mesti berikatan dengan atom karbon (ikatan H-C).
Sebuah kumpulan dari atom karbon yang terangkai disebut juga dengan rumus
kerangka. Secara umum, jumlah atom karbon digunakan untuk mengukur
berapa besar ukuran alkana tersebut (contohnya: C2-alkana).Gugus alkil, biasanya
disingkat dengan simbol R, adalah gugus fungsional, yang seperti alkana, terdiri
dari ikatan karbon tunggal dan atom hidrogen, contohnya adalah metil
atau gugus etil.
Klasifikasi struktur
Hidorkarbon tersaturasi
dapat berupa:
1.
lurus (rumus umum CnH2n + 2),
kerangka karbon membentuk rantai lurus tanpa ada cabang
2.
bercabang (rumus umum CnH2n + 2,
n > 3), kerangka karbon utamanya mempunyai cabang-cabang
3.
siklik (rumus umum CnH2n,
n > 2), ujung-ujung kerangka karbonnya bertemu sehingga membentuk
suatu siklus.
Menurut definisi dari IUPAC, 2 golongan pertama di atas dinamakan
alkana, sedangkan golongan yang ketiga disebut dengan sikloalkana.Hidrokarbon
tersaturasi juga dapat membentuk gabungan ketiga macam rantai diatas, misalnya
linear dengan siklik membentuk polisiklik. Senyawa seperti ini masih disebut
dengan alkana (walaupun tidak mempunyai rumus umum), sepanjang tetap berupa asiklik (tidak seperti siklus).
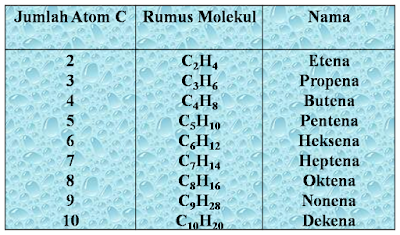
Alkena atau olefin dalam kimia organik adalah hidrokarbon tak
jenuh dengan sebuah ikatan rangkap dua antara atom
karbon. Alkena asiklik yang paling sederhana,
yang membentuk satu ikatan rangkap dan tidak berikatan dengan gugus fungsional manapun, maka akan membentuk
suatu kelompok hidrokarbon dengan rumus
umum CnH2n.
Alkena yang paling
sederhana adalah etena atau etilena (C2H4)
Senyawa aromatik seringkali juga digambarkan seperti
alkena siklik, tapi struktur dan ciri-ciri mereka berbeda sehingga tidak
dianggap sebagai alkena.
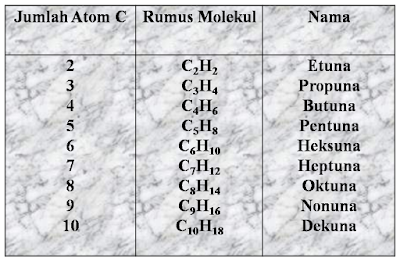
ALKUNA
Alkuna merupakan deret senyawa
hidrokarbon tidak jenuh yang dalam tiap molekulnya mengandung satu ikatan
rangkap 3 diantara dua atom C yang berurutan. Untuk membentuk ikatan rangkap 3
atau 3 ikatan kovalen diperlukan 6 elektron, sehingga tinggal satu elektron
pada tiap-tiap atom C tersisa untuk mengikat atom H. Jumlah atom H yang dapat
diikat berkurang dua, sehingga rumus umumnya menjadi
CnH2n+2 - 4H =
CnH2n-2
2. Senyawa Hidrokarbon Aromatik
Senyawa aromatik adalah senyawa
hidrokarbon dengan ikatan tunggal dan ikatan rangkap diantara atom-atom
karbonnya. kongfigurasi 6 atom karbon pada senyawa ini di kenal dengan cincin
benzene.
Sifat-sifat senyawa aromatik.
Sifat-sifat senyawa aromatik.
1. Sifat fisik
- zat cair tidak berwarna
- memiliki bau yang khas
- mudah menguap
- benzene digunakan sebagai pelarut
- tidak larut dalam pelarut polar seperti air tetapi larut dalam senyawa yang kurang polar seperti eter dan tetraklorometana.
- larut dalam berbagai pelarut organik
- benzena dapat membentuk campuran azeotrop dengan air
- densitas : 0,88
- bersifat toksik karsinogenik ( hati-hati menggunakan benzena sebagai pelarut hanya gunakan jika tidak ada alternatif lain misalnya toluena .
- merupakan senyawa nonpolar
- tidak begitu reaktif tetapi mudah terbakar dengan menghasilkan banyak jelaga
- lebih mudah mengalami reaksi subtitusi dari pada adisi
a). Cincin aromatik sederhana
Cincin aromatik sederhana, juga
dikenal sebagai arena sederhana atau senyawa aromatik sederhana, merupakan senyawa organik
aromatik yang hanya terdiri dari struktur cincin planar berkonjugasi dengan
awan elektron pi yang
berdelokalisasi. Banyak senyawa cincin aromatik sederhana yang mempunyai nama
trivial. Biasanya, ia ditemukan sebagai substruktur molekul-molekul
yang lebih kompleks. Senyawa aromatik sederhana yang umumnya ditemukan adalah benzena
dan indola.
Cincin aromatik sederhana dapat
berupa senyawa heterosiklik apabila ia mengandung atom bukan karbon. Ia dapat
berupa monosiklik seperti benzena, bisiklik seperti naftalena, ataupun polisiklik seperti antrasena. Cincin aromatik monosiklik
sederhana biasanya berupa cincin beranggota lima, seperti pirola, ataupun
cincin beranggota enam, seperti piridina.
b). Cincin aromatik heterosiklik
Cincin aromatik yang mengandung atom
nitrogen dapat dibedakan menjadi cincin aromatik basa dan cincin aromatik
non-basa.
- Pada cincin aromatik basa, pasangan menyendiri elektron bukanlah bagian dari sistem aromatik cincin tersebut. Pasangan menyendiri ini bertanggungjawab terhadap kebasaan basa ini. Dalam senyawa-senyawa ini, atom nitrogen tidak berikatan dengan atom hidrogen. Contoh cincin aromatik basa adalah piridina dan kuinolina. Beberapa cincin bisa saja mengandung atom nitrogen basa dan non-basa secara bersamaan, misalnya imidazola dan purina..
- Pada cincin non basa, pasangan menyendiri elektron atom nitrogen berdelokalisasi dan berkontribusi terhadap sistem aromatik elektron pi. Dalam senyawa ini, atom nitrigen berikatan dengan atom hidrogen. Contoh cincin aromatik non-basa ini adalah pirola dan indola.

Assalamualaikum wr wb, bisa saya ingin bertanya dari artikel diatas, Menurut anda senyawa alifatik dibedakan menjadi apa saja?tolong jelaskan terima kasih
BalasHapusWaalaikumsalam Warahmatullah nina^^
BalasHapusTerima Kasih atas pertanyaannya, saya akan mencoba menjawabnya senyawa alifatik itu dibedakan menjadi :
1. Hidrokarbon jenuh/tersaturasi adalah hidrokarbon yang paling sederhana. Hidrokarbon ini seluruhnya terdiri dari ikatan tunggal dan terikat dengan hidrogen. Rumus umum untuk hidrokarbon tersaturasi adalah C nH2n+2 .Hidrokarbon jenuh merupakan komposisi utama pada bahan bakar fosil dan ditemukan dalam bentuk rantai lurus maupun bercabang. Hidrokarbon dengan rumus molekul sama tapi rumus strukturnya berbeda dinamakan isomer struktur.
2. Hidrokarbon tak jenuh/tak tersaturasi adalah hidrokarbon yang memiliki satu atau lebih ikatan rangkap, baik rangkap dua maupun rangkap tiga. Hidrokarbon yang mempunyai ikatan rangkap dua disebut dengan alkena, dengan rumus umum C nH2n .Hidrokarbon yang mempunyai ikatan rangkap tiga disebut alkuna, dengan rumus umum C nH2n-2 .
Assalamualaikum anisa, saya ingin menambahkan sedikit penjelasan yang sudah anda buat Hidrokarbon aromatik adalah kelas bahan kimia yang ditandai dengan memiliki struktur molekul yang disebut cincin benzena. Yang paling sederhana adalah kimiawi benzena, dan struktur hidrokarbon ini meminjamkan nama menjadi cincin benzena. Banyak hidrokarbon ini beracun, dan mereka sayangnya di antara polutan organik yang paling tersebar luas.
BalasHapusBenzena adalah senyawa induk dari keluarga besar senyawa organik yang dikenal sebagai senyawa aromatik. Tidak seperti sikloheksana, benzena hanya berisi enam atom hidrogen, memberikan kesan bahwa cincin itu adalah tak jenuh dan setiap atom karbon berpartisipasi dalam satu ikatan rangkap. Dua struktur yang berbeda dengan ikatan tunggal dan ganda sekitar cincin dapat ditulis kembali untuk benzena. Sebuah cincin benzena adalah struktur molekul yang dibuat ketika enam atom karbon terhubung satu sama lain dalam sebuah cincin terkait. Setiap atom karbon memiliki empat elektron; dua elektron bergabung dengan atom karbon tetangga, sementara salah satu pergi ke atom hidrogen. Yang keempat adalah apa yang dikenal sebagai elektron terdelokalisasi, yang berarti bahwa itu tidak terlibat langsung dengan atom tertentu. Cincin Benzena sering diambil sebagai bentuk heksagonal dengan lingkaran di tengah untuk mewakili elektron terdelokalisasi. Benzena terjadi menjadi bentuk yang sangat beracun dari hidrokarbon aromatik.
Waalaikumsalam Warahmatullah ditta^^
HapusAlhamdulillah, terima kasih atas tambahannya ditta, semoga bisa bermanfaat bagi yang membuka artikel ini^^
Assalammualaikum anisa, setelah saya membaca postingan resume anda diatas, saya ingin menambahkan sedikit mengenai senyawa aromatik atau benzena yang mana Teori resonansi dapat menerangkan mengapa benzena sukar diadisi. Sebab, ikatan rangkap dua karbon-karbon dalam benzena terdelokalisasi dan membentuk semacam cincin yang kokoh terhadap serangan kimia, sehingga tidak mudah diganggu. Oleh karena itulah reaksi yang umum pada benzena adalah reaksi substitusi terhadap atom H tanpa mengganggu cincin karbonnya.
BalasHapusWaalaikumsalam Warahmatullah dika^^
HapusAlhamdulillah, terima kasih atas tambahannya dika, semoga bisa bermanfaat bagi yang membuka artikel ini^^