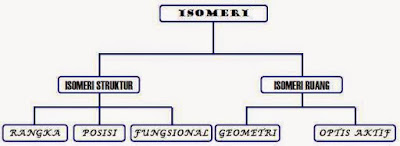
ISOMER
STRUKTUR SENYAWA KARBON
Senyawa karbon
merupakan senyawa organik yang tersusun
atas atom karbon dan atom lainnya. Senyawa
karbon saat ini jenis dan jumlahnya sangatlah banyak, jadi untuk memberi nama
senyawa tersebut makin sulit. Untuk mengatasinya dibuatlah suatu peraturan yang
sistematik untuk tata nama senyawa tersebut yang dikembangkan dan diawasi yang disebut
dengan sistem nomenklatur IUPAC (International
Union of Pure and Applied Chemistry), yang terdiri dari 3 bagian yaitu : Prefix (awalan cabang dengan akhiran -il),
Parent (jumlah atom karbon pada
rantai utama), Suffix (akhiran).
Contohnya
:
C5H12
= Pentana => suffix (ana) dan parent
5
R-Mg-X => parent (R=gugus alkil), prefix (Mg), dan
suffix (X=halida)
Nama-nama beberapa alkana tidak bercabang yang sering disebut sebagai deret homolog dapat dilihat pada tabel berikut:
Nama
|
Rumus molekul
|
Nama
|
Rumus molekul
|
metana
|
CH4
|
heksadekana
|
C16H34
|
etana
|
C2H6
|
heptadekana
|
C17H36
|
propana
|
C3H8
|
oktadekana
|
C18H38
|
butana
|
C4H8
|
nonadekana
|
C19H40
|
pentana
|
C5H12
|
eikosana
|
C20H42
|
heksana
|
C6H14
|
heneikosana
|
C21H44
|
heptana
|
C7H16
|
dokosana
|
C22H46
|
oktana
|
C8H18
|
trikosa
|
C23H48
|
nonana
|
C9H20
|
tetrakosana
|
C24H50
|
dekana
|
C10H22
|
pentakosana
|
C25H52
|
undekana
|
C11H24
|
keksakosana
|
C26H54
|
dodekana
|
C12H26
|
heptakosana
|
C27H56
|
tridekana
|
C13H26
|
oktaoksana
|
C28H58
|
tetradekana
|
C14H30
|
nonakosana
|
C29H60
|
pentadekana
|
C15H32
|
trikontana
|
C30H62
|
ISOMER
STRUKTUR
Isomer
itu berasal dari bahasa yunani : iso yang berarti sama, dan meros yang berarti
bagian. Jadi isomer struktural adalah
senyawa dari rumus kimia yang sama yang memiliki
struktur dan sifat fisika dan sifat kimia (kestabilan) yang berbeda didasarkan pada bagaimana konstituen atom
mereka diurut.
Sebagai contoh, ada dua isomer struktural dengan sama rumus
kimia C4H10, CH3CH2CH2CH3 butana yaitu normal dan metilpropana
(CH3)2CHCH2CH3. Sangat menarik
untuk dicatat butana yang normal mendidih pada -0.5 derajat Celsius, sedangkan
metilpropana mendidih pada suhu 28 derajat Celcius. Karena jumlah atom
bertambah, jumlah isomer meningkat. Ada tiga isomer struktural dengan rumus
kimia C5H12, lima dengan
rumus C6H14 dan sembilan dengan rumus C7H16.
Isomer
struktural karbon tidak dibatasi hanya untuk karbon dan hidrogen, meskipun
mereka adalah contoh paling terkenal dari isomer struktural. Di lemari obat
rumah tangga orang dapat menemukan C3H8O, atau isopropil
alkohol, kadang-kadang diidentifikasi sebagai “alkohol.” Rumus struktur adalah
CH3CH (OH) CH3. Selain itu, ada
n-propil alkohol, CH3CH2CH2 (OH) dan bahkan eter metiletil, CH3OCH2CH3, meskipun tak
satu pun dari kedua senyawa ini kemungkinan akan ditemukan di rumah.
Jenis-jenis isomer struktur :
1.
Isomer Rangka
Isomer rangka adalah
isomeri yang terjadi karena perbedaan rangkanya, biasanya terjadi antara senyawa
rantai lurus dengan senyawa yang
memiliki cabang, bisa pula antar senyawa yang memiliki cabang, namun berbeda
pada posisi dan jumlah cabang.
Contoh : butana memiliki
dua isomer yaitu, normal butana (n-butana) dan isobutana (2-metilpropana)
2.
Isomer Posisi
Isomer posisi adalah
isomeri yang terjadi karena perbedaan posisi ikatan rangkap. Isomeri ini hanya
terjadi pada senyawa hidrokabon tak jenuh (alkena dan alkuna).
Contoh : butena memiliki
dua isomer posisi yaitu, 1-butena dan 2-butena
3.
Isomer Fungsional
Isomer fungsional adalah
isomer yang berbeda golongan. Keisomeran fungsi terjadi karena perbedaan gugus
fungsi diantara senyawa yang mempunyai rumus molekul sama. Sebagai contoh,
rumus molekul dari etanol (C2H6O) yang merupakan golongan
alkohol dan dimetil eter yang merupakan golongan eter. Dari segi sifat fisisnya
titih didih etanol lebih tinggi dari dimetil eter, sedangkan dari segi sifat
kimianya etanol lebih reaktif dari dimetil eter sehingga lebih mudah bereaksi
ETILENA
Yang perlu diperhatikan
adalah :
·
Panjang ikatan
·
Sudut ikatan
Contoh :
Panjang ikatan :
C-C => 0,154 nm
C=C => 0, 134 nm
Kenapa panjang ikatan C=C
lebih pendek dari panjang iktan C-C?
Jawabannya : karena
interaksi ikatan pi yang menyebabkan panjang ikatan itu memendek
TUGAS :
Mengapa sudut ikatan H-C-C
(sudut ikatannya=121) lebih besar dibanding sudut ikatan H-C-H (sudut
ikatannya=117) ?
Jawab : Karena elektron valensi
atom pusat yang digunakan pada pembentukan senyawa kovalen terkadang digunakan
untuk membentuk ikatan kadang tidak digunakan. Elektron yang tidak digunakan
digunakan ditulis sebagai pasangan elektron bebas (PEB). Sedangkan electron yang
digunakan dalam pembentukan ikatan ditulis sebagai pasangan electron ikatan
(PEI). Selain PEB dan PEI pada atom pusat dapat pula terdapat electron tidak
berpasangan seperti molekul NO2. Dalam suatu molekul elektron-elektron
tersebut saling tolak-menolak karena memiliki muatan yang sama. Untuk mengurangi
gaya tolak tersebut atom-atom yang berikatan membentuk struktur ruang tertentu
hingga tercapai gaya tolak yang minimum. Akibat yang ditimbulkan dari tolakan
yang terjadi yaitu mengecilnya sudut ikatan dalam molekul. Jadi itulah penyebab
sudut ikatan H-C-C lebih besar dari sudut ikatan H-C-H.


Assalamualaikum nisa, fitri mau bertanya tentang pengertian
BalasHapusIsomer fungsional adalah isomer yang berbeda golongan.maksud berbeda golongan itu bagaimana dan tolong berikan contohnya
Waalaikumsalam Warahmatullah safitri^^
Hapussaya akan mencoba menjawabnya maksud dari berbeda golongan pada variasi dari struktur isomer ini, isomer mengandung grup (golongan) fungsional yang berbeda- yaitu isomer dari dua jenis kelompok molekul yang berbeda. Sebagai contoh, sebuah formula molekul C3H6O dapat berarti propanal (aldehid) or propanon (keton). Keisomeran fungsi terjadi karena perbedaan gugus fungsi diantara senyawa yang mempunyai rumus molekul sama.
itu saja yang dapat saya jawab terima kasih^^
asslamualaikum saya rini akan sedikit membantu anisa dalam menjawab pertanyaan dari safitri yang dimaksud berbeda golongan yaitu dilihat dari perbedaan gugus fungsi dimana Keisomeran fungsi terjadi karena perbedaan gugus fungsi diantara senyawa yang mempunyai rumus molekul sama. Sebagai contoh, rumus molekul dari etanol (C2H6O) yang merupakan golongan alkohol dan dimetil eter yang merupakan golongan eter. Dari segi sifat fisisnya titih didih etanol lebih tinggi dari dimetil eter, sedangkan dari segi sifat kimianya etanol lebih reaktif dari dimetil eter sehingga lebih mudah bereaksi karena kepolaran senyawa etanol sedangkan dimetil eter bersifat non polar.
BalasHapusWaalaikumsalam Warahmatullah^^
HapusAlhamdulillah terima kasih atas bantuan kak rini dalam menjawab pertanyaan dari safitri^^
Assalamu'alaikum anisa..
BalasHapusDari postingan diatas saya ingin bertanya dapatkah anda berikan contoh isomer struktural berdasarkan sifat fisika dan kimia?
Terima kasih
Waalaikumsalam Warahmatullah reni,
BalasHapusbaiklah saya akan mencoba menjawabnya, contoh dri isomer struktural berdasarkan sifat fisika dan kimia adalah C4H10, CH3CH2CH2CH3 butana yaitu normal dan metilpropana (CH3)2CHCH2CH3 sebagai isomernya . Berdasarkan sifat fisika butana yang normal mendidih pada -0.5 derajat Celsius, sedangkan metilpropana mendidih pada suhu 28 derajat Celcius. Karena jumlah atom bertambah, jumlah isomer meningkat, ini berdasarkan sifat kimianya. Menurut saya seperti itu, terima kasih^^