TEORI ATOM MEKANIKA KUANTUM
Teori Atom Mekanika Kuantum didasarkan pada dualisme sifat elektron yaitu sebagai gelombang dan sebagai partikel.
Menurut de Broglie, cahaya dapat berperilaku sebagai materi dan berperilaku sebagai gelombang (dikenal dengan istilah dualisme gelombang partikel). Menurut Heisenberg, tidak mungkin menentukan kecepatan dan posisi elektron secara bersamaan, tetapi yang dapat ditentukan hanyalah kebolehjadian menemukan elektron pada jarak tertentu dari inti.
Erwin Schrodinger mengajukan teori yang disebut teori atom mekanika kuantum ”Kedudukan elektron dalam atom tidak dapat ditentukan dengan pasti yang dapat ditentukan adalah kemungkinan menemukna elektron sebagai fungsi jarak dari inti atom”.
Daerah dangan kemungkinan terbesar ditemukan elektron disebut orbital. Orbital digambarkan berupa awan, yang tebal tipisnya menyatakan besar kecilnya kemungkinan ditemukan elektron di daerah tersebut. Kemudian Werner Heisenberg mengemukakan bahwa metode eksperimen yang digunakan untuk menemukan posisi atau momentum suatu partikel seperti elektron dapat menyebabkan perubahan, baik pada posisi, momentum atau keduanya.
Teori Schrodinger dan prinsip ketidakpastian Heisenberg melahirkan model atom mekanika kuantum sebagai berikut:
- Posisi elektron dalam atom tidak dapat ditentukan dengan pasti.
- Atom mempunyai kulit elektron.
- Setiap kulit elektron memiliki subkulit elektron.
- Setiap subkulit elektron memiliki sub-sub kulit elektron.
BENTUK ORBITAL
Setiap subkulit disusun oleh satu atau lebih orbital dan setiap orbital mempunyai bentuk tertentu. Adapun bentuk orbital di tentukan oleh bilangan kuantum azimut. Perhatikan gambar bentuk-bentuk orbital berdasarkan harga l (bilangan kuantum azimut).
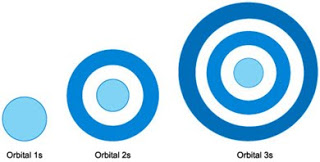
Orbital s yang berbentuk bola tidak menunjukan arah ruang tertentu karena kebolehjadian ditemukan elektron dengan bentuk ini berjarak sama jauhnya ke segala arah dari inti atom. Inti atom terdapat pada pusat bola. Perhatikanlah gambar arah ruang orbital s berikut ini :
Kebolehjadian terbesar ditemukannya elektron dalam orbital s terdapat pada daerah sekitar bola, yaitu untuk orbital :
a. 1s : terdapat pada kulit bola
b. 2s : terdapat pada awan lapisan kedua
c. 3s : terdapat pada awan lapisan ketiga.
Gambaran kebolehjadian ditemukan orbital pada masing-masing kulit :
Subkulit p terdiri dari tiga orbital p. Karena nilai bilangan kuantum magnetiknya ada tiga yaitu –1, 0, dan +1. Ketiga orbital ini mempunyai tingkat energi yang sama tetapi arah ruangnya masing-masing berbeda. Jika digabungkan, ketiga orbital ini saling tegak lurus satu sama lain. Bila digambarkan pada sistem koordinat kartesius yang memiliki sumbu X, Y, dan Z maka orbital p yang terletak pada sumbu X disebut orbital px, sedangkan yang terletak pada sumbu Y disebut orbital py. Begitu pula halnya dengan orbital p yang terletak pada sumbu Z disebut orbital pz, perhatikan gambar berikut ini!
Sehingga gambaran orbital p dengan bilangan kuantum azimut l =1 dinyatakan dalam gambar berikut ini!
Untuk mengambarkan orbital atom p, ambillah 3 buah balon. Kemudian pilin (putar) pada bagian tengah balon. Lakukan hal ini pada semua balon. Siapkan tali pengikat yang akan digunakan untuk menggabungkan ketiga balon. Balon pertama diletakkan tegak lurus (vertikal), sedangkan balon kedua diletakkan mendatar (horizontal), dan balon ketiga diletakkan diantara balon pertama dan balon kedua. Bagian balon yang dipilin harus berada di tengah-tengah ikatan dari ketiga balon yang diikat menjadi satu. Pastikan bahwa ketiga balon ini terikat dengan kuat.
Subkulit d terdiri dari 5 orbital d karena nilai bil kuantum magnetiknya –2, -1, 0, +1, +2. Seperti halnya orbital p, orbital d juga memiliki tingkat energi yang sama tetapi arah ruangnya masing-masing berbeda. Bila digambarkan pada sistem koordinat kartesius maka ketiga orbital d menempati ruang antar sumbu pada koordinat kartesius tersebut. Masing-masing orbital dinyatakan sebagai dXY, dXZ dan dYZ, sedangkan dua orbital d lainnya terletak pada sumbu koordinat kartesius yang masing-masing orbital dinyatakan sebagai dX2-Y2 dan dZ2. Bentuk kelima orbital d dapat digambarkan sebagai berikut:
Orbital dZ2 terletak pada sumbu Z
Orbital dX2-Y2 terletak pada sumbu X dan Y
Orbital dXY terletak antara sumbu X dan Y
Orbital dXZ terletak antara sumbu X dan Z
Orbital dYZ terletak antara sumbu Y dan Z
Untuk menggambarkan orbital d yaitu : pada orbital d mempunyai 4 orbital dengan bentuk seperti 2 balon terpilin yaitu dxy, dxz, dyz dan dx2-y2 dengan satu bentuk orbital yang berbeda yaitu orbital dz2.
Sedangkan orbital f memiliki 7 obital seperti yang digambarkan sebagai berikut:
Dalam penggambaran orbital atom akan semakin rumit, sebagai contoh penggambaran orbital atom pada atom-atom yang no atomnya kecil seperti atom Li, Be, B dan C adalah sebagai berikut :
TEORI ORBITAL MOLEKUL
Ikatan pada Orbital Molekular
• Untuk membentuk molekul yang stabil maka elektron di dalam orbital ikatan harus lebih banyak dibandingkan di dalam orbital anti-ikatan
• Ikatan yang terbentuk akan berada pada energi yang lebih rendah, sehingga menjadi lebih stabil
• Orbital ikatan dan anti-ikatan untuk ikatan-s dan ikatan-p harus dipertimbangkan
Fungsi gelombang elektron dalam suatu atom disebut orbital atom. Karena kebolehjadian menemukan elektron dalam orbital molekul sebanding dengan kuadrat fungsi gelombang, peta elektron nampak seperti fungsi gelombang. Suatu fungsi gelombang mempunyai daerah beramplitudo positif dan negatif yang disebut cuping (lobes). Tumpang tindih cuping positif dengan positif atau negatif dengan negatif dalam molekul akan memperkuat satu sama lain membentuk ikatan, tetapi cuping positif dengan negatif akan meniadakan satu sama lain tidak membentuk ikatan. Besarnya efek interferensi ini mempengaruhi besarnya integral tumpang tindih dalam kimia kuantum.
Dalam pembentukan molekul, orbital atom bertumpang tindih menghasilkan orbital molekul yakni fungsi gelombang elektron dalam molekul. Jumlah orbital molekul adalah jumlah atom dan orbital molekul ini diklasifikasikan menjadi orbital molekul ikatan, non-ikatan, atau antiikatan sesuai dengan besarnya partisipasi orbital itu dalam ikatan antar atom. Kondisi pembentukan orbital molekul ikatan adalah sebagai berikut.
Setiap baris dalam diagram orbital molekul menggambarkan sebuah orbital molekul yang terisi oleh elektron. Orbital molekul ini mencakup seluruh molekul. Diasumsikan bahwa elektron akan terisi pada orbital molekul sama seperti elektron terisi pada orbital atom dengan mengikuti aturan aufbau, kaidah Hund, serta larangan Pauli. Salah satu pendekatan yang digunakan untuk menggambarkan diagram orbital molekul untuk molekul diatomk adalah Linear Combination of Atomic Orbitals approach (LCAO/Pendekatan Kombinasi Linear Orbital Atom). Pendekatan diatas memuat hal-hal sebagai berikut,
- Orbital molekul terbentuk dari overlap atau tumpang tindih orbital atom
- Hanya orbital-orbital atom dengan energi yang sama yang dapat berinteraksi pada tingkat enegi yang signifikan
- Ketika 2 orbital saling tumpang tindih keduanya berinteraksi membentuk 2 orbital molekul, yaitu Bonding Molecular Orbital (Orbital Molekul Ikatan) dan Anti-bonding Molecular Orbital (Orbital Molekul Anti-ikatan)
Pendekatan yang digunakan berasumsi bahwa 2 orbital atom 1s dapat saling tumpang tindih dengan 2 cara untuk membentuk 2 orbital molekul. Cara yang pertama adalah adalah berinteraksi secara In-Phase. Ketika orbital atom saling tumpang tindih, interaksi secara In-Phase menyebabkan peningkatan intensitas muatan negatif pada area dimana kedua orbital atom tersebut saling tumpang tindih. Hal ini menimbulkan gaya tarik yang lebih besar antara elektron dan inti atom. Gaya tarik yang lebih besar mengarah kepada energi potensial yang lebih rendah.
Karena elektron pada orbital molekul memiliki energi potensial yang lebih rendah daripada elektron pada orbital atom, maka tentunya untuk memisahkan kembali elektron pada orbital 1s masing-masing atom diperlukan sejumlah energi (tidak akan terjadi secara spontan) yang menyebabkan ikatan yang terbentuk akan stabil. Hal ini menjaga agar atom-atom tetap stabil pada molekul. Orbital molekul yang terbentuk ini disebut Bonding Molecular Orbital (Orbital molekul Ikatan). Orbital ini akan simetris terhadap sumbu ikatan. Orbital molekul jenis ini disebutSigma Molecular Orbital (Orbital Molekul Sigma), σ. Simbol σ1s digunakan untuk menggambarkan orbital molekul ikatan yang terbentuk dari 2 orbital atom 1s.
Cara yang kedua, yaitu berinteraksi secara Out-of-Phase. Ketika orbital atom saling tumpang tindih, interaksi secara Out-of-Phase menyebabkan penurunan intensitas muatan negatif. Hal ini menimbulkan gaya tarik yang lebih lemah antara elektron dan inti atom. Gaya tarik yang lebih lemah mengarah kepada energi potensial yang lebih tinggi. Elektron akan lebih stabil jika berada pada orbital 1s masing-masing atom, sehingga elektron dalam orbital molekul ini akan melemahkan ikatan antar atom. Orbital molekul kenis ini disebut Anti-bonding Molecular Orbital (Orbital Molekul Anti-ikatan). Orbital molekul ini juga akan simetris terhadap sumbu ikatan, sehingga orbital ini adalah orbital molekul sigma namun dengan simbol σ*1s. Tanda * mengindikasikan orbital molekul anti-ikatan.
Berikut ini adalah aturan-aturan yang digunakan dalam menggambarkan diagram orbital molekul
- Tentukan jumlah elektron dalam molekul. Jumlah elektron per atom diperoleh dari nomor atom pada tabel periodik (Jumlah total elektron buakn hanya elektron valensi)
- Isi orbital molekul dari bawah hingga ke atas sampai semua elektron terisi
- Orbital harus terisi dengan spin yang sejajar sebelum elektron nya mulai berpasangan (Kaidah Hund). Kemudian stabil tidaknya suatu molekul ditentukan melalui orde ikatan (Bond Order).







assalamualaikum anisa saya rini anjani ingin bertanya contoh daro Orbital molekul yang terbentuk dari overlap atau tumpang tindih orbital atom itu seperti apa ? mohon penjelasannya terima kasih
BalasHapusWaalaikumsalam Warahmatullah kak rini^^
HapusContoh orbital molekul yang terbentuk dari overlap atau tumpang tindih ini adalah orbital molekul untuk ikatan sigma dari orbital s dan p. Disini saya tidak bisa memperlihatkan gambar yang saling timpang tindih itu seperti apa, kakak bisa melihatnya pada blog ini http://viviruthmia.web.unej.ac.id/2015/04/05/teori-ikatan-valensi-dan-teori-orbital-molekul/
Terima kasih^^
assalamualaikum wr wb
BalasHapussaya Nia Paramita (A1C115015)
saya ingin menambahkan,
bahwa sebelum de broglie mengemukakan cahaya sebagai gelombang, pada tahun 1900 Max Planck mengemukakan bahwa gelombang cahaya memiliki sifat partikel, dan transfer suatu radiasi elektromagnetik berlangsung dalam paket atau satuan energi yang disebut kuantum. Planck berpendapat bahwa kuanta yang berbanding lurus dengan frekuensi tertentu dari cahaya, semuanya harus berenergi sama, hal ini dapat dilihat dengan persamaan :
E = hV
Ket E : Energi kuantum
h : Tetapan Planck (6,626 x 10 -34 J.s)
V : Frekuensi
semoga bermanfaat, terimakasih
Waalaikumsalam Warahmatullah nia^^
HapusAlhamdulillah, terima kasih atas tambahannya nia, semoga bisa bermanfaat bagi yang membuka artikel ini^^
assalamualaikum. sedikit menambahkan:
BalasHapusOrbital molecular adalah hasil tumpang-tindih dan penggabungan orbital atomic pada molekul.Menurut pendekatan lurus (linear combination), jumlah molecular yang bergabu ng sama dengan orbital atomic yang bergabung. Bila dua atom yang bergabung masing – masing menyedia
kan satu orbital atomic maka dihasilkan dua orbital molecular, salah satu merupak an kombinasi jumlahan kedua orbital atomic yang saling menguatkan dan lainnya kombin asi kurangan yang saling meniadakan.
Kombinasi jumlahan menghasilkan orbital molecular ikat (bonding) yang mempunyai energy lebih rendah, dan kombinasi kurangan menghasilkan orbital molecular antiikat (antibonding).
Orbital molecular ikat (bonding) yaitu orbital dengan rapatan electron ikat terpusat mendekat pada daerah antara kedua inti atom yang bergabung dan dengan demikian menghasilkan situasi yang lebih stabil.
Orbital molecular antiikat (antibonding) yaitu orbital dengan rapatan electron ikat terpusat menjauh dari daerah antara inti atom yang bergabung dan menghasilkan situasi kurang stabil.
Jika pada daerah tumpang-tindih ada orbital atonik yang tidak bereaksi dalam pembentukan ikatan, orbital ikatan yang dihasilkan disebut orbital nonikat (nonbonding).
Waalaikumsalam Warahmatullah ayu^^
HapusAlhamdulillah, terima kasih atas tambahannya ayu, semoga bisa bermanfaat bagi yang membuka artikel ini^^